При анализе банка заданий ЕГЭ по молекулярной физике и
термодинамике http://www.fipi.ru/content/otkrytyy-bank-zadaniy-ege , бросается в глаза обилие задач на графики изопроцессов.
Для решения таких задач нужно хорошо запомнить графики
отдельных процессов в разных координатах:
На каждом из рисунков а-в изотерма представлена сплошной
линией, изохора – пунктирной, а изобара – «короткопунктирной». Необходимо также
знать, что изобара в координатах V-T и
изохора в координатах Р-T являются прямыми, выходящими из начала координат.
Часто приходится перерисовывать изопроцесс, представленный в
одних координатах, – в другие. Здесь, кроме знания вида изопроцесса в новых
координатах, необходимо правильно передать его направление. Например, на
изотерме АВ в координатах V-T, точку А можно пытаться
поставить как снизу, так и сверху. Но правильный вариант один. Чтобы определить
направление процесса на новом графике, проанализируйте изотерму на исходном
графике. Найдите на нем ту координату, которая есть и на новом графике (в
данном случае V) и
определите, что V(В)>
V(A). Следовательно, и на новом графике
должно быть также.
 Кроме вышесказанного, нужно соотносить характеристики
двух подобных изопроцессов на одном графике. Причем, помнить это совершенно
необязательно. Нужно уметь определить и даже объяснить, как это делается.
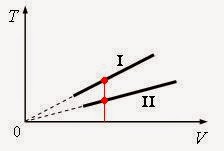
Например, в следующем задании ЕГЭ нужно пояснить, почему изобара I лежит
выше изобары II?
Кроме вышесказанного, нужно соотносить характеристики
двух подобных изопроцессов на одном графике. Причем, помнить это совершенно
необязательно. Нужно уметь определить и даже объяснить, как это делается.
Например, в следующем задании ЕГЭ нужно пояснить, почему изобара I лежит
выше изобары II?
Для соотнесения параметров этих кривых пользуются известным
приемом: рисуют перпендикуляр к одной из осей (см., например, красную линию на
рис.). Так как на красной линии V(I)=V(II) и Т(I)>T(II),
то, согласно уравнению Клапейрона-Менделеева P∙V/T=const для данной
массы газа (это соотношение называется универсальным газовым законом), и Р(I)> Р(II). Так что изобара I лежит выше
изобары II, потому что соответствует более высокому давлению.
Этот же подход можно применить, решая задания с
головоломными изменениями состояния газа. Например, на рисунке ниже нужно
определить, как изменилось давление при переходе 1-2.
Для проведения расчетов необходимо уметь пользоваться
уравнением Клапейрона-Менделеева.
Оно универсально, из
него можно вывести уравнения законов отдельных изопроцессов при постоянной
массе газа, его можно использовать, когда газ вытекает из сосуда или его масса
увеличивается в результате различных манипуляций.
Рассмотрим задачу:
В баллоне находится газ при температуре 15 оС. Во
сколько раз уменьшится давление газа, если 40% его выйдет из баллона, а
температура понизится на 8 оС?
Решение: Так как в
задаче даны изменение температуры и доля изменения массы, представим уравнение
состояния газа в начале и в конце процесса через эти величины
Так как нужно найти, во сколько раз изменилось давление,
смело делим левые и правые части этого уравнения друг на друга. А потом еще обе
части –на m, чтобы
получить долю массы. Попробуйте посчитать ответ (p1/p2=1.7).



Комментариев нет:
Отправить комментарий